Chuyên đề nâng cao lý thuyết nguyên tử phân tử 8 là bước tiến quan trọng, giúp học sinh lớp 8 nắm vững nền tảng hóa học. Bài viết này sẽ cung cấp kiến thức chuyên sâu, phân tích chi tiết và hướng dẫn cụ thể về chuyên đề này, giúp các em chinh phục những bài tập khó và đạt điểm cao trong các kỳ thi.
Cấu Tạo Nguyên Tử: Hạt Nhân và Lớp Vỏ Điện Tử
Cấu tạo nguyên tử là nền tảng của hóa học. Nguyên tử gồm hạt nhân mang điện tích dương và lớp vỏ electron mang điện tích âm. Hạt nhân chứa proton và neutron, trong khi electron quay xung quanh hạt nhân theo các lớp và phân lớp nhất định. Sự sắp xếp electron này quyết định tính chất hóa học của nguyên tử. Chuyên đề nâng cao lý thuyết nguyên tử phân tử 8 sẽ đào sâu vào cấu trúc này.
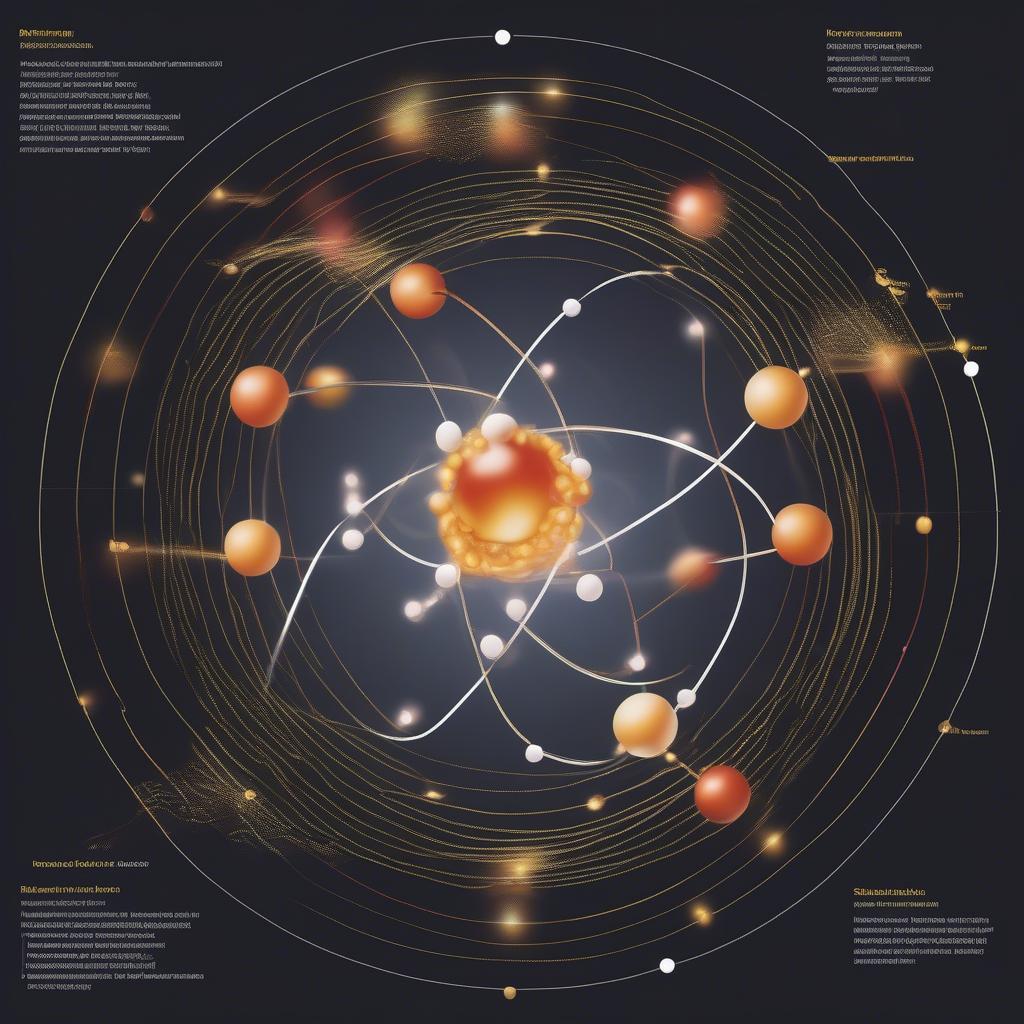 Cấu tạo nguyên tử
Cấu tạo nguyên tử
Hiểu rõ về cấu tạo nguyên tử giúp học sinh dễ dàng giải thích các hiện tượng hóa học như liên kết hóa học, phản ứng hóa học và tính chất của các chất. Việc nắm vững kiến thức này là chìa khóa để học tốt hóa học ở các lớp cao hơn.
Liên Kết Hóa Học: Liên Kết Ion và Liên Kết Cộng Hóa Trị
Liên kết hóa học là lực hút giữa các nguyên tử, giúp chúng liên kết với nhau tạo thành phân tử. Chuyên đề nâng cao lý thuyết nguyên tử phân tử 8 tập trung vào hai loại liên kết chính: liên kết ion và liên kết cộng hóa trị. Liên kết ion hình thành do sự cho nhận electron giữa các nguyên tử, trong khi liên kết cộng hóa trị hình thành do sự dùng chung electron giữa các nguyên tử.
Ví dụ, trong phân tử NaCl, Na cho electron cho Cl tạo thành liên kết ion. Trong phân tử H₂O, các nguyên tử H và O dùng chung electron tạo thành liên kết cộng hóa trị.
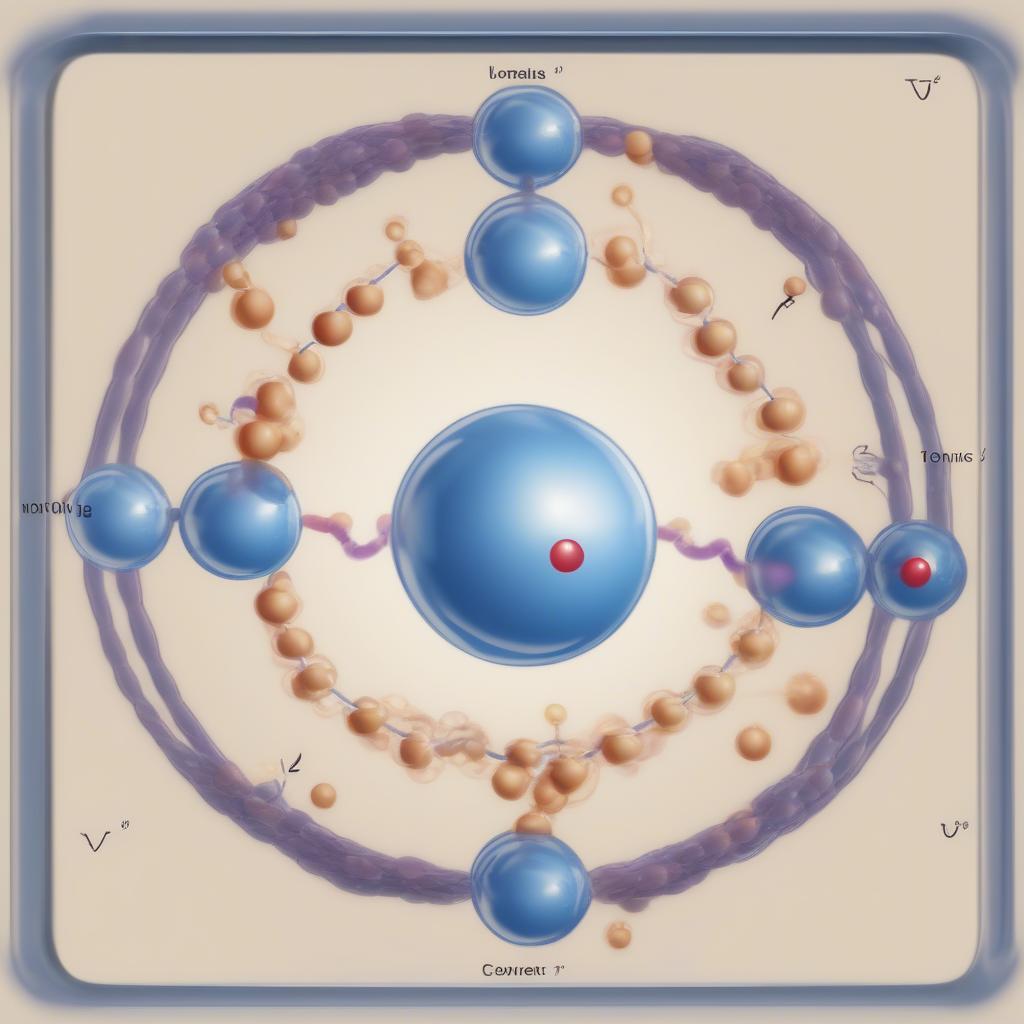 Liên kết hóa học
Liên kết hóa học
Sự khác biệt giữa hai loại liên kết này ảnh hưởng đến tính chất của các hợp chất. Ví dụ, hợp chất ion thường có nhiệt độ nóng chảy cao, trong khi hợp chất cộng hóa trị thường có nhiệt độ nóng chảy thấp.
Phân Tử và Công Thức Hóa Học
Phân tử là tập hợp các nguyên tử liên kết với nhau bằng liên kết hóa học. Công thức hóa học biểu diễn thành phần nguyên tử của một phân tử. Chuyên đề nâng cao lý thuyết nguyên tử phân tử 8 hướng dẫn học sinh cách viết và đọc công thức hóa học của các hợp chất đơn giản.
Ví dụ, công thức hóa học của nước là H₂O, cho biết mỗi phân tử nước gồm hai nguyên tử hydro và một nguyên tử oxy.
Chuyên Đề Nâng Cao Lý Thuyết Nguyên Tử Phân Tử 8: Ứng Dụng Trong Thực Tiễn
Việc hiểu rõ về nguyên tử, phân tử và liên kết hóa học có rất nhiều ứng dụng trong thực tiễn. Ví dụ, trong lĩnh vực y học, kiến thức về cấu trúc phân tử giúp các nhà khoa học phát triển các loại thuốc mới.
 Ứng dụng thực tiễn
Ứng dụng thực tiễn
Trích dẫn từ chuyên gia:
GS.TS Nguyễn Văn A, Viện Hóa Học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam: “Nắm vững lý thuyết nguyên tử phân tử là nền tảng quan trọng để học tốt hóa học và ứng dụng vào thực tiễn.”
PGS.TS Trần Thị B, Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội: “Chuyên đề nâng cao lý thuyết nguyên tử phân tử 8 giúp học sinh phát triển tư duy logic và khả năng giải quyết vấn đề.”
Kết luận
Chuyên đề nâng cao lý thuyết nguyên tử phân tử 8 là kiến thức cốt lõi trong chương trình hóa học lớp 8. Việc nắm vững kiến thức này sẽ giúp học sinh có nền tảng vững chắc để học tốt hóa học ở các lớp cao hơn. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về chuyên đề nâng cao lý thuyết nguyên tử phân tử 8.
FAQ
- Nguyên tử gồm những hạt nào?
- Liên kết ion là gì?
- Liên kết cộng hóa trị là gì?
- Công thức hóa học của nước là gì?
- Ứng dụng của lý thuyết nguyên tử phân tử trong thực tiễn là gì?
- Làm thế nào để học tốt chuyên đề này?
- Tài liệu nào hỗ trợ học chuyên đề này?
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc phân biệt liên kết ion và liên kết cộng hóa trị, cũng như cách viết công thức hóa học.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các bài viết liên quan đến hóa học lớp 8 trên website của chúng tôi.

